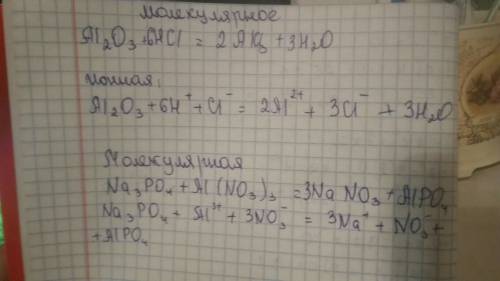
ответ: 18
Объяснение:
Теория вопроса. То что 1 моль газа при нормальных условиях занимает объем 22,4 литра, это не закон Авогадро, а следствие из него. А сам закон говорит, что если взять разные газы в одинаковом объеме, при одинаковых условиях, то в этом объеме будет содержаться одинаковое количество молекул. Верно и обратное, одинаковое количество разных газов в одинаковых условиях будут занимать одинаковый объем. То есть для газов можно оперировать в пропорциях не только молями, но и объемами, и одновременно молями и объемами.
\ce{ 2H2S(газ) + 3O2(газ) -> 2SO2 (газ) + 2H2O}2HX
2
S(газ)+3OX
2
(газ)
2SOX
2
(газ)+2HX
2
O
По уравнению реакции 2 моль H2S требуют 3 моль O2
12 литров H2S требуют Х литров O2
Запишем это выражение в виде пропорции:
\displaystyle { \frac{2} {12} = \frac{3} {Х} }
12
2
=
Х
3
\displaystyle { Х=\frac{12 \cdot 3} {2}=18\; литров.}Х=
2
12⋅3
=18литров.
ответ:
объяснение:
дано:
m(р2о5) = 22,72 г
найти:
m(р) -?
решение:
1. составим уравнение реакции горения фосфора:
4 р + 5 о2 = 2 р2о5
по уравнению:
в реакцию вступает 4 моль фосфора;
образуется 2 моль оксида фосфора(v).
найдём массу фосфора по формуле:
m(р) = n*m = 4 моль * 31 г/моль = 124 г
найдём массу оксида фосфора(v) по формуле:
m(р2о5) = n*m = 2 моль * (31*2 + 16*5) = 284 г
2. вычислим массу сгоревшего красного фосфора, составив пропорцию:
х г р - 22,72 г р2о5
124 г р - 284 г р2о5
отсюда, х = 124 * 22,72 / 284 = 9,92 г
ответ: m(р) = 9,92 г
А) Al2O3 + 6HCl = 2AlCl3 + 3H2O
Al2O3 + 6H(+) + 6Cl(-) = 2Al(3+) + 6Cl(-) + 3H2O
Al2O3 + 6H(+) = 2Al(3+) + 3H2O
Na3PO4 + Al(NO3)3 = 3NaNO3 + AlPO4
3Na(+)+ PO4(3-) + Al(3+) + 3NO3(-) = 3Na(+) + 3NO3(-) + AlPO4
Al(3+) + PO4(3-) = AlPO4