1. А) N2 + 3Н2 = 2NН3 - соединения
Б) 3Mg + 2H3РО4 = Mg3(РО4)2 +3 H2↑ - замещения
В) 2Al(OH)3 = Al2O3 + 3H2O - разложения
Г) 2Cu2O = 4Cu + O2↑ - разложения
2. Na2CO3 + 2HCl = 2NaCl + H2O + CO2 - ионного обмена.
признаки: выделение воды и газа, индикатор показывает нейтральный pH (в первом растворе (Na2CO3) изначально показывалась щелочная среда, во втором (HCl) - кислая)
2 + + 2+2=2+2+ H2O + CO2
+ 2=H2O + CO2
3. 2Mg+O2=2MgO
Магний+кислород=оксид магния
MgO+2HCl=MgCl2+H2O
оксид магния+соляная кислота=хлорид магния +вода
MgCl2+2KOH=Mg(OH)2+2KCl
хлорид магния+гидроксид калия= гидроксид магния + хлорид калия
4. 2 + 6 =2 +3
--3e-> 3 2 окислитель
2-+2e-> 2 3 восстановитель
Объяснение:
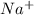

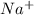
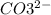

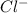
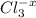


m[Al₂(SO₄)₃]=34,2г.
Объяснение:
Дано:
m(технічAI₂O₃)=10,73г.
ω₁(домішок)=0,05
m(технічH₂SO₄)=32,7г.
ω₂(домішок)=0,1
m(солі )-?
Рішення:
1. Визначимо масу чистого оксиду алюмінію:
m(домішок)=ω₁(домішок)×m(технічAI₂O₃)=0,05×10,73г.=0,54г
m(AI₂O₃)= m(технічAI₂O₃)-m(домішок)=10,73г.-0,54г=10,19г.=10,2г.
2. Визначимо молярну масу оксиду алюмінію і його кількість речовини:
M(AI₂O₃)=27х2+16х3=54+48=102г./моль
n(AI₂O₃)=m(AI₂O₃)÷M(AI₂O₃)=10,2г.÷г.102г./моль=0.1моль
3. Визначимо масу чистої сульфатної кислоти:
m(домішок)=ω₂(домішок)×m(техніч.H₂SO₄)=0,1×32,7гг.=3,27г.
m(H₂SO₄)= m(техніч.H₂SO₄)-m₂(домішок)=32,7г.-3,27г.=29,43г.
4. Визначимо молярну масу сульфатної кислоти і її кількість речовини:
М(H₂SO₄) =2+32+64=98г./моль
n₁(H₂SO₄)=m(H₂SO₄)÷М(H₂SO₄)=29,43г.÷98г./моль=0,3моль
5.Запишемо рівняння ракції:
AI₂O₃+3H₂SO₄=AI₂(SO₄)₃+3H₂O
за рівнянням реакції:
n(AI₂O₃)=1моль n(H₂SO₄)=3моль
n(AI₂O₃)=n(AI₂(SO₄)₃)=1моль
за умовою задачі:
n₁(AI₂O₃)=0,1моль n₁(H₂SO₄)=0,3моль
n₁(AI₂O₃)=n₁(AI₂(SO₄)₃)=0,1моль
6. Визначимо молярну масу сульфату алюмінію і його масу кількістю речовини моль:
M[Al₂(SO₄)₃]=2x27+3[32+(4x16)]=54+3x96=54+288=342г./моль
m[Al₂(SO₄)₃]=n₁(AI₂(SO₄)₃)×M[Al₂(SO₄)₃]=0,1моль×342г./моль=34,2г.
7. Відповідь: утворилась маса солі 34,2г.
2Na+Cl2=2NaCl
4K+O2=2K2O