11,2 л х моль
1. 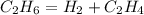
22,4 л 1 моль
1) Найдем количество вещества этилена:
при разложении 22,4 л этана образуется 1 моль этилена,а
при -- // -- 11,2 л________________х моль, откуда
х=11,2*1/22,4=0,5 моль
2) Найдем объем этилена:
V(C2H4)=Vm*v(C2H4)=22,4*0,5=11,2 л
150 000 л х г
2. 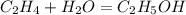
22,4 л 46 г
1.Найдем массу спирта,учитывая,что 150 кубометров- это 150 000 л:
при взаимодействии 22,4 л этилена образуется 46 г спирта, а
при -- // -- 150 000 л______________х г, откуда
х=150000*46/22,4=308036 г или 308 кг
1) Рассчитаем массу соляной кислоты (HCl):
m(HCl) = 200 x(знак умножения) 0.15 = 30 г
2) Составляем уравнение реакции:
Na2S + 2HCl = NaCl + H2S(это и есть искомый газ);
3) Вычислим избыток и недостаток:
n(Na2S) = 5.5 /(знак деления) 78 = 0.07 моль
n(HCl) = 30 /(знак деления) (36.5 x(знак умножения) 2) = 0.4 моль
4) Делаем вывод, что соляна кислота у нас в избытке. Значит расчет делаем по сульфиду натрия
5) Рассчитаем обьем сероводорода (H2S):
5.5 /(знак деления) 78 = X(икс) / 22.4
X(икс) = 5.5 x(знак умножения) 22.4 / 78 = 1.6 л
ответ: V(H2S) = 1.6 л