1 )оксид лития-Li2O
гидроксид натрия NaOH
Серная кислота - H2SO4
Оксид углерода - CO2
2 NaOH + H2SO4= Na2SO4 + 2 H2O
Li2O + H2SO4 = Li2SO4 + H2O
Li2O + CO2 = Li2CO3 ( при нагревании )
CO2 + 2 NaOH(избыток или расплав) = Na2CO3 + H2O
CO2(избыток) + NaOH = NaHCO3
2)
4 P+ 5 O2 = 2 P2O5 ( На самом деле: P4 (фосфор- белый) + 5 O2 = P4O10 P.S все немного сложнее) для общего развития реакция идет примерно так но в школе писать не советую, если интересно посмотрите )
P2O5 + H2O = H3PO4 ( опять же реакция для школьной химии )
3 KOH + H3PO4 = K3PO4 + 3 H2O
K3PO4 + Сa(OH)2 = Ca3(PO4)2↓ + KOH
Ca3(PO4)2 + 3 H2SO4 = 2 H3PO4 + 3 CaSO4
3)
фосфат алюминия- Al PO4
сульфид серебра - Ag2S
оксид марганца - MnO3
гидроксид магния Mn(OH)2
хлорид аммония NH4Cl
нитрат свинца (II) Pb (NO3)2
4)
a) Mg+ CuSO4 = MgSO4 + Cu
4 Mg + 5 H2SO4(концентрированная) = 4 MgSO4 + H2S↑ + 4 H2O
б) CaO+ H2O= Ca(OH)2
Ca(NO3)2 + KOH = KNO3 + Ca(OH)2↓
Ca + H3PO4 = Ca
5) 2AgNO3 + CuCl2 = 2AgCl↓ + Cu(NO3)2
Дано: Решение:
m(AgNO3) = 1,7 г n ( AgNO3) = m/M = 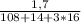 = 0,01 моль = n(AgCl)
= 0,01 моль = n(AgCl)
m ( AgCl) - ? m (AgCl)= n(AgCl) * M(AgCl)= 0,01 моль*
(108г/моль+35,5г/моль) = 1,435 г
ответ: 1,435 г
P.S. n- количество вещества ( еще обозначают как ν - "ню" )
6) CaO + H2SO4 = CaSO4 + H2O
Дано: n (CaO) - ?
m(H2SO4) = 14,7 г
n(H2SO4) = m/M = 14,7 г/ (2г/моль+32г/моль+4*16г/моль) = 0,15 моль=
= n(CaSO4)
m(CaSO4) = n*M = 0,15 моль*(40г/моль + 32г/моль+4*16г/моль)= 15,3 г
7)
Я не могу тут сделать нормальную таблицу, поэтому пусть это таблица : по горизонтали то что мы добавляем в пробирки по вертикали признаки реакции
----- | HNO3 | Ba(NO3)2
Na2CO3 | CO2↑ | помутнение воды
NaNO3 | -- | --
Na2SO4 | -- | осадок
Na2CO3 +2 HNO3 = H2O + CO2↑ + 2NaNO3
NaNO3 + HNO3 ≠
Na2SO4 + HNO3 ≠
Na2CO3 + Ba(NO3)2= BaCO3↓ + 2 NaNO3
Na2SO4 + Ba(NO3)2 = BaSO4↓ + 2 NaNO3
Существуют различные методы защиты металлов от коррозии, Лакокрасочные покрытия –наиболее распространенный вид антикоррозионной защиты металла. В качестве пленкообразующих материалов используют нитроэмали, нефтяные, каменноугольные и синтетические лаки, краски на основе растительных масел и др. Образующаяся при покрытии на поверхностях конструкций плотная пленка изолирует металл от воздействия окружающей его влажной среды.
Неметаллические покрытия довольно разнообразны. К ним относят эмалирование, покрытие стеклом, цементно-казеиновым составом, листовым пластиком и плитками, напыление пластмасс
Металлические покрытия наносят на металлы гальваническим, химическим, горячим, металлизацией и другими
При гальваническом защиты на поверхности металла путем электролитического осаждения из раствора солей металлов создается тонкий защитный слой какого-либо металла. Химическая обработка поверхности металла – изделия погружают в ванну с расплавленным защитным металлом.
Металлизация – распространенный защиты металлов в строительстве. Он состоит в нанесении сжатым воздухом тончайшего слоя распыленного расплавленного металла.
При защите легированием в металл вводят легирующие элементы, повышающие сопротивление сплава коррозии. Защита от огня.
Для защиты металлоконструкций наиболее перспективны вспучивающиеся покрытия или краски на основе полимерных связующих, которые при воздействии огня образуют закоксовавшийся вспененный расплав, препят-ствующий нагреву металла.
Для повышения предела огнестойкости (600 °С) металлических, в том числе алюминиевых, конструкций применяют также асбестоцементные, асбестоперлитовые, асбестовермикулитовые покрытия, наносимые пневмонапылением.
Новый вид огнезащиты – фосфатное покрытие толщиной 20-30 мм, представляющее собой стойкую (при 1000 °С) монолитную легкую массу.
Традиционные увеличения предела огнестойкости, использование облицовок и штукатурок из несгораемых огнезащитных материалов (кирпича, пустотелой керамики, гипсовых плит, растворов и др.).