1.Разотрите в ступке смесь 3-4 г ацетата натрия и 12-15 г гидроксида кальция. Внесите смесь в сухую жаропрочную пробирку-реактор 7 и распределите равномерно по ее длине и ширине. 2.Укрепите пробирку-реактор в лапке штатива наклонно (рис. 21) для того, чтобы образующийся метан вытеснил воздух из пробирки (ме¬тан легче воздуха). Пробирку закройте пробкой с газоотводной труб¬кой 2 и смесь нагрейте.
3.Убедитесь в отсутствии примесей в выделяющемся газе. Для этого со¬берите под водой его небольшую порцию: наполните водой пробир¬ку, закройте пробкой и опустите вверх дном в кристаллизатор 4 с во¬дой. Уберите пробку и введите в пробирку газоотводную трубку.
4.После того как газ вытеснит воду из пробирки, извлеките из нее газо¬отводную трубку и закройте пробирку под водой пробкой. Удалите пробирку из кристаллизатора, выньте пробку и поднесите к отвер¬стию пробирки горящую лучинку. Если газ загорается без хлопка, опыт можно продолжать, используя наполненный водой цилиндр 3.
5.Соберите выделяющийся метан в цилиндр методом вытеснения воды. Закройте цилиндр под водой стеклянной пластинкой и выньте его из кристаллизатора. Удалите газоотводную трубку из кристаллизатора с водой и только после этого прекратите нагревание. Сдвинув плас¬тинку с цилиндра, подожгите газ. После окончания горения налейте в цилиндр известковую воду и встряхните.
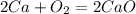
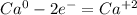 ·2 восстановитель полуреакция окисления
·2 восстановитель полуреакция окисления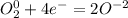 ·1 окислитель полуреакция восстановления
·1 окислитель полуреакция восстановления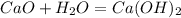
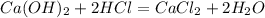
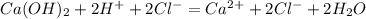
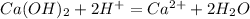
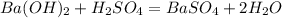
![m[Ba(OH)_2]=](/tpl/images/0276/7725/752a4.png) =50 · 0,18 = 9 г
=50 · 0,18 = 9 г![n[Ba(OH)_2]= \frac{m[Ba(OH)_2]}{M[Ba(OH)_2]} = \frac{9}{171} =0,0526](/tpl/images/0276/7725/43f28.png) моль
моль![n(BaSO_4)=n[Ba(OH)_2]=0,0526](/tpl/images/0276/7725/a4a1c.png) моль
моль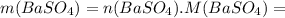 =0,0526 · 233=12,2558 г ≈12,26 г
=0,0526 · 233=12,2558 г ≈12,26 г
n (CO2) = 11.2 / 22.4 = 0.5 моль
M (CO2) = 12*1 + 16*2 = 44 г/моль
m = 44*0.5 = 22 г
Объяснение:
Спочатку знаходимо кількість речовини через даний нам об'єм:
Формула: n=V/Vm , Vm завжди дорівнює 22,4
n (CO2) = 11.2 / 22.4 = 0.5 моль
Формулу для знаходження маси також виводимо з формули для знаходження кількості речовини через маси:
n = m/M звідси m = n*M
Знаходимо молярну масу вуглекислого газу:
M (CO2) = 12*1 + 16*2 = 44 г/моль
Підставляємо значення в формулу, яку вивели раніше (m = n*M):
m = 44*0.5 = 22 г