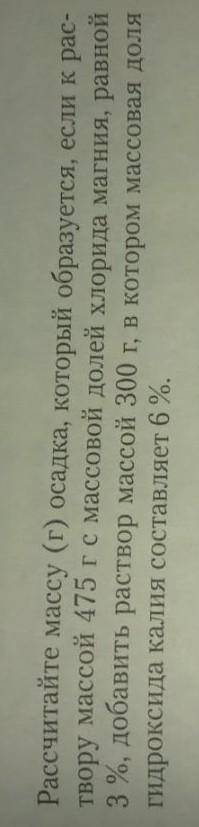
Диэтилкетон
(3-пентанон)
Тип вещества: органическое
Внешний вид: бесцветн. жидкость
Брутто-формула (система Хилла): C5H10O
Формула в виде текста: CH3CH2COCH2CH3
Молекулярная масса (в а.е.м.): 86,132
Температура плавления (в °C): -39,8
Температура кипения (в °C): 101,7
Растворимость (в г/100 г растворителя или характеристика):
вода: 8,2 (0°C)
вода: 5,2 (25°C)
вода: 3,7 (80°C)
диэтиловый эфир: хорошо растворим
этанол: хорошо растворим
Плотность: 0,8138 (20°C, относительно воды при 4°C, состояние вещества - жидкость)
получения:•Каталитической кетонизацией пропионовой кислоты при нагревании над оксидами металлов нанесенными на оксид алюминия (наиболее активные катализаторы - оксиды урана, тория, церия, марганца, циркония или железа при 450°С).
Реакции вещества:
Реагирует с малоновой кислотой при нагревании в присутствии пиридина с образованием 3-этилпент-2-еновой кислоты. (выход 30%)
(CH3CH2)2CO + CH2(COOH)2 → (CH3CH2)2C=CHCOOH + CO2 + H2O
Показатель преломления (для D-линии натрия): 1,3924 (20°C)
Стандартная энтальпия образования ΔH (298 К, кДж/моль): -296,5 (ж)
Стандартная энтропия вещества S (298 К, Дж/(моль•K)): 266 (ж)
Стандартная мольная теплоемкость Cp (298 К, Дж/(моль•K)): 190,9 (ж)
Стандартная энтальпия образования ΔH (298 К, кДж/моль): -257,9 (г)
Физико-химические свойства. С5Н10О. М.м.86,1. Бесцветная жидкость. Т.кип. 102,2°, Т.всп. 13°. Плотность 0,816. Растворимость в воде 4%. Образует с водой азеотропную смесь. Хорошо растворяется в отрганических растворителях.
Получение. Нагреванием солей, например, марганца, хрома, тория, пропионовой кислоты при 400-500°; из этилена, СО и спирта (например 2-пропанола) при 150-220° под давлением (катализатор - соединения кобальта).
Применение. Растворитель в производстве лаков и красок; для депарафинизации нефтепродуктов.
Антропогенные источники поступления в окружающую среду. Атмосферные выбросы производств растворителей, лаков, красок, нефтеперерабатывающих.
Токсическое действие. Животные. При в/ж введении мышам ЛД50 = 3200 мг/кг. Судя по изменению СПП, для крыс ПКостр = 1250 мг/м3. Проникает через неповрежденную кожу крыс: ЛД50 = 2100 мг/кг.
Человек. ПКодор = 1700 мг/м3.
Гигиенические нормативы. ПДКр.з = 200 мг/м3, пары, класс опасности 4. ПДКм.р = 0,5 мг/м3, ПДКс.с = 0,3 мг/м3, класс опасности 3. ПДКв = 0,1 мг/л, органолептический признак, класс опасности 4.
Зарубежные стандарты: TWA OSHA = 200 млн-1 (700 мг/м3); STEL ACGIH = 250 млн-1 (875 мг/м3); IDLH = 500 млн-1.
Методы определения. В воздухе. ГХ с пламенно-ионизационным детектором, чувствительность 0,001 мкг, погрешность 20%
получение сульфата магния из гидроксида магния.
Молек. Уравнение:Mg(OH)2+H2SO4=MgSO4+2H2O
Ионное: Mg(OH)2+ 2H+ + SO4 2- = Mg2+ + SO4 2- +2H2O
получение сульфата магния действием серной кислоты на магний:
молекулярное уравнение: Mg+H2SO4=MgSO4+H2(СТРЕЛКА ВВЕРХ)
Ионное: Mg2+ + 2H+ + so4 2- = Mg2+ + SO4 2- + 2H+
получение из хлорида магния
молек: MgCl2 + H2SO4= MgSO4+ 2HCl
ион: mG2+ + 2Cl- + 2H+ + SO4 2- = Mg2+ + SO4 2- +2H+ + 2Cl-
Действие серной кислоты на оксид магния
молек: MgO+ H2SO4= MgSO4+ H2O
ион: MgO + 2H+ + SO4 2- = Mg2+ + SO4 2 - +H2O
Действие на карбонат магния сульфатом аммония(при 100 градусах по цельсию, если не ошибаюсь.)
Молек: MgCO3 + (NH4)2SO4= MgSO4+ 2NH3(СТРЕЛКА ВВЕРХ) + CO2(СТРЕЛКА ВВЕРХ) + H2O
Ионное: MgCO3 + 2NH4 + + SO4 2- =Mg2+ + SO4 2- +2NH3 + CO2 + H2O
Объяснение:
w=m(в-ва) /m(р-ра)
MgCl2+2KOH=Mg(OH) 2(осадок) +2KCl
3%=x/475
X=475*0,03
X=14,25г - m(MgCl2)
6%=y/300
Y=300*0,06
Y=18г - m(KOH)
n(KOH) =m/M=18/56=0,32 моль
n(MgCl2) =m/M=14,25/94=0,15моль
Составляя пропорцию, по которой будем находить n(Mg(OH) 2), берем n(MgCl2), т к его химическое кол-во меньше, а значит хим кол-во KOH будет такое же, а остаток не прореагирует.
1:0,15=1:x
n(Mg(OH)2)=0,15 моль
m(Mg(OH)2)=nM=0,15*58=8,7 г
Объяснение: