![NH_{2}CH_2COOH+HCl=[NH_3CH_2COOH]^+Cl^-](/tpl/images/0644/2167/91ce1.png)
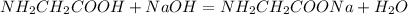
Пример 1. Вычислите осмотическое давление раствора, содержащего в 1,5 л 135 г глюкозы C6H12O6 при 0 0С.
Решение:Осмотическое давление определяется по закону Вант-Гоффа:
См RТ
Молярную концентрацию раствора находим по формуле:
.
Подставляя значение молярной концентрации в выражение закона Вант-Гоффа, рассчитываем осмотическое давление:
π = См RТ= 0,5 моль/л ∙ 8,314 Па∙м3/моль∙К∙273=1134,86 ∙103 Па
Пример 2.Определите температуру кипения раствора, содержащего 1,84 г нитробензола C6H5NO2 в 10 г бензола. Температура кипения чистого бензола 80,2 0С.
Решение: Температура кипения раствора на ∆tкип будет выше, чем температура кипения чистого бензола: tкип(раствора)= tкип(растворителя) + ∆tкип;
По закону Рауля: ∆tкип = Е∙ Сm ,где Е-эбуллиоскопическая константа растворителя (табличная величина),Сm – моляльная концентрация раствора, моль/кг
∆tкип = Е∙ Сm =1,5 ∙ 2,53=3,8 0С.
tкип(раствора)= tкип(растворителя) + ∆tкип =80,2 0С +3,8 0С=84 0С.
901. Раствор, содержащий 57 г сахара С12Н22О11 в 500 г воды, кипит при 100,72 0С. Определите эбуллиоскопическую константу воды.
902. Раствор, содержащий 4,6 г глицерина С3Н8О3 в 71 г ацетона, кипит при 56,73 0С. Определите эбуллиоскопическую константу ацетона, если температура кипения ацетона 56 0С.
903. Вычислите температуру кипения раствора, содержащего 2 г нафталина С10Н8 в 20 г эфира, если температура кипения эфира 35,6 0С, а его эбуллиоскопическая константа 2,16.
904. 4 г вещества растворены в 100 г воды. Полученный раствор замерзает при -0,93 0С. Определите молекулярную массу растворённого вещества.
905. Определите относительную молекулярную массу бензойной кислоты, если 10 % раствор её кипит при 37,57 0С. Температура кипения эфира 35,6 0С, а его эбуллиоскопическая константа 2,16.
фосфата магния Mg3(PO4)2
карбонат цинка ZnCO3
иодит кальций Cal2