Объяснение:
Вычислите массу осадка который образуется при взаимодействии хлорида бария с 71 г 20% раствора сульфата натрия
BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl
Про хлорид бария в задаче ничего не говорится - значит это вещество взято в избытке.
Про сульфат натрия известно, масса этого раствора 71 г с массовой долей растворенного вещества 20%
Вычислим массу сульфата натрия в растворе
m(Na2SO4) = 71 г× 0,2 = 14,2 г.
Молярная масса сульфата натрия равна 142 г/моль, молярная масса сульфата бария 233 г/моль.
Тогда количество вещества сульфата натрия составит 0,1 моль
14,2 г : 142 г/ моль = 0,1 моль
и по уравнению реакции сульфата бария тоже 0,1 моль
Вычислим массу осадка: 233 г/моль × 0,1 моль = 23,3 г
1) Определить Активную кислотность мочи, если известно, что pH мочи = 3,4. Соответствует ли pH физиологической норме?
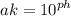
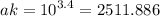
pH не соответствует. Норма - 5-7.
2) BaCl2+Na2SO4(изыбыток)=BaSO4(осадок)+2NaCl
Постройте мицеллу, используя уравнение выше. С какого правила вы определили ПОИ?
Na2SO4 - стабилизатор = 2Na(+) + SO4(2-)
BaSO4 - адсорбент
{ [mBaSO4]×nSO4(2-) (2n-x) Na}(x-)xNa(+)
п.Панета-Фаянса
3) Энтальпии образования CO и CO2 соответственно равны -110,5 и -393,5. Определить энтальпию реакции CO+0.5O2=CO2
Объяснение:
A) C2H5OH + 3O2 = 2CO2 + 3H2O
Б) 2CH3-COOH + CaO=(CH3-COO)2Ca+H2O