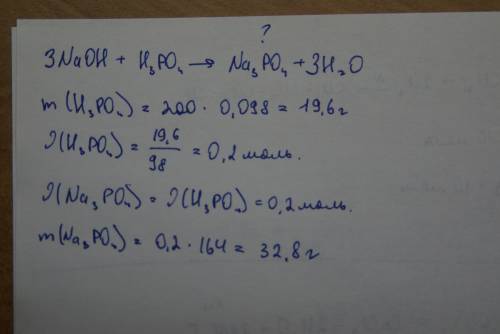
Объяснение:
Составить уравнение:
1. 2F₂+O₂=2OF₂
2. MnO₂+4HCl=MnCl₂+Cl₂↑+2H₂O
3. 2H₂S+3O₂=2SO₂+2H₂O
4. Na₂SO₄+ BaCI₂=BaSO₄↓+2NaCI
Составить уравнение:
Бромид калия→ бром→бромоводород→бромид натрия→нитрат натрия
2KBr+F₂=2KF+Br₂
Br₂+H₂O=HBr+HBrO
HBr+NaOH=NaBr+H₂O
NaBr+AgNO₃=NaNO₃+AgCI↓
Определить вещества Х:
1. CI₂→X→HNO₃
CI₂+HNO₂+H₂O=HNO₃+2HCI
2.Cu→X→FeSO₄
Сu+H₂SO₄=CuSO₄+SO₂+H₂O
CuSO₄+Fe=FeSO₄+Cu
3. NaHSO₃→X→SO₂
NaHSO₃+HCI=NaCI+ H₂SO₃
H₂SO₃⇄H₂O+SO₂
Решить задачу:
Дано:
KOH
V(SO₂)=1,32л.
Vm=22,4л./моль
m(раствора K₂SO₃)=82,72г.
m(K₂SO₄)-?
1. Определим количество вещества оксида серы(IV):
n(SO)₂=V(SO₂)÷Vm=1,32л.÷22,4л./моль=0,5моль
2. Составим уравнение реакции:
2KOH+SO₂=K₂SO₃+H₂O
а) по уравнению реакции количество вещества:
n(SO₂)=1моль n(K₂SO₃) =1моль
б) по условию задачи количество вещества:
n₁(SO₂)=0,5моль n₁(K₂SO₃) =0,5моль
3. Определим молярную массу сульфита калия и его массу количеством вещества 0,5моль:
M(K₂SO₃)=158г./моль
m(K₂SO₃)= n₁(K₂SO₃)×M(K₂SO₃)=0,5моль×158г./моль=79г.
4. Определим массовую долю сульфита калия в растворе:
ω%(K₂SO₃)= m(K₂SO₃)÷m(раствора K₂SO₃)=79г.÷82,72г.×100%=95,5%:
5. ответ: массовая доля сульфита калия в растворе 95,5%
Дано:
ω(Н₃РО₄) = 36% или 0,36
ρ(р-ра Н₃РО₄) = 1,216 г/мл
Найти:
См - ?
Объяснение:
См = n(Н₃РО₄)/V(p-pa Н₃РО₄)
Примем объем раствора Н₃РО₄ равным 1 л или 1000 мл
Масса р-ра Н₃РО₄ m(p-paН₃РО₄) = ρ(р-ра Н₃РО₄)*V(p-pa H₃PO₄)
m(p-pa H₃PO₄) = 1000 мл*1,216 г/мл = 1216 г
Находим массу ортофосфорной к-ты (безводной):
m(H₃PO₄) = m(p-pa H₃PO₄)*ω(Н₃РО₄) = 1216 г*0,36 = 437,76 г
М(Н₃РО₄) = 98 г/моль
Находим к-во в-ва Н₃РО₄
n(H₃PO₄) = m/M = 437,76 г/98 г/моль = 4,467 моль
Вычисляем молярность по вышенаписанной формуле:
См = 4,467 моль/1 л = 4,467 моль/л
ответ: 4,467 моль/л