І.Выберите три верных ответа. С водородом реагируют оба вещества в наборах: 1,3,5
ІІ.1.Сначала определим массу соли в первоначальном растворе:
m1(соли)=m1(раствора)*w1(соли)=100*0,15=15 г
2.Узнаем массу соли в новом растворе,сложив уже имеющуюся(ту,что только что определили) и добавленную:
m(соли)=m1(соли)+m2(соли)=15+50=65 г
3.Вычислим массу нового раствора,сложив массу первоначального раствора с массой добавленной соли:
m2(раствора)=m1(раствора)+m2(соли)=100+50=150 г
4. Отнеся массу соли в новом растворе к массе этого раствора,получим массовую долю соли в новом растворе:
w2(соли)=m(соли)/m2(раствора)=65/150=0,43 или 43%
ІІІ.
+7 -1 +2 0
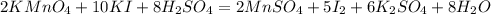
+7 +2
Mn + 5e = Mn|2| окислитель(восстановление)
-1 0
2I - 2e = I2 |5| восстановитель(окисление)
IV.
4488 г х л
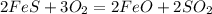
176 г 44,8 л
1. Определим чистую массу сульфида в образце:
5610 г образца - это 100%,
у г_______________80%, откуда у=5610*80/100=4488 г
2. По этой массе,подставив ее в уравнение реакции,определим объем сернистого газа:
при взаимодействии 176 г сульфида образуется 44,8 л сернистого газа, а
при --//--//-- 4488 г__________________Х л, откуда=
х=4488*44,8/176=1142 л или 1,142 м в кубе
Дано:
m(HNO3)=12,6г
n(Cu(OH)2)=?
m(Cu(OH)2)=?
Решение.
Cu(OH)2+2HNO3=Cu(NO3)2+2H2O
n(HNO3)=m\m=12,6г/(1+14+38)г\моль=12,6г/53 г\моль=0,24 моль
Из уравнения реакции
n(Cu(OH)2)=n(HNO3)\2=0,12г
m(Cu(OH)2)=n*M=0,12г*(64+1*2+16*2)г\моль=0,12г*98г/моль=11,76 г
ответ:n(Cu(OH)2)=0,12 моль m(Cu(OH)2)=11,76 г
№2.
Дано:
m(K)=7,8г
m(KOH)=?
Решение.
2K+2H2O=2KOH+H2
n(K)=m\M=7,8г/39г\моль=0,2 моль
Из уравнения реакции
n(K)=n(KOH)=0,2 моль
m(KOH)=n*M=0,2 моль*(39+16+1) г/моль=0,2 моль*56 г\моль=11,2 г
ответ:n(KOH)=0,2 моль m(KOH)=11,2г