2Ca + O2 = 2СаO
CaO+H2O = Ca(OH)2
Ca(OH)2 + 2HNO3 = Ca(NO3)2+ 2H2O
Ca(NO3)2 + BaCO3 = CaCO3 +Ba(NO3)2
металл - оксид - гидроксид - нитрат (соль) - карбониат (соль)
В певром превращении у кальция и кислорода по отдельности степень окисления равны по нулю. В оксиде кальция степень окисления у кислорода равна -2 , а у кальция +2. Следовательно, кислород "отобрал" у кальция два электрона и поменял степень окисления с большую на меньшую. Кислород - ОКИСЛИТЕЛЬ. А кальций - ВОССТАНОВИТЕЛЬ
Ca(2+)+2NO3(-) + Ba(2+)+CO3(2-) = CaСО3 +Ba(2+)+ 2NO3(-)
Сa(2+)+ CO3(2-) =CaCO3
В реакции образуется осадок карбонат кальция, который не является электролитом и не распадается на ионы
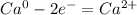 2 восстановитель
2 восстановитель 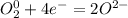 окислитель
окислитель 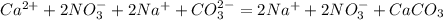
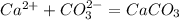
Vm=22,4 м3/кмоль
n(SO2)=3500/22,4=156,25 кмоль
M(FeS2)=120 кг/кмоль
n(FeS2):n(SO2)=4:8=1:2, отсюда n(FeS2)=156,25/2=78,125 кмоль
m(FeS2)=78,125х120=9375 тонн - чистого пирита