1.
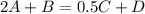
Выражение для константы равновесия:
![K = \frac{[C]^{0.5}[D]}{[A]^{2}[B]}](/tpl/images/0972/8582/67d8a.png)
Очевидно, равновесная концентрация вещества B равна:
![[B] = \frac{0.2^{0.5}*0.1}{38*10^{-2}*0.5^2} = 0.471](/tpl/images/0972/8582/b8eb2.png) моль/дм^3
моль/дм^3
2.
Уравнение, связывающее мольную долю и массовую долю:
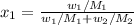
Мольная доля воды в растворе равна:
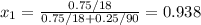
Примем данный раствор идеальным. Тогда равновесное давление паров компонентов над раствором выражается через закон Рауля:
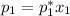
Отсюда находим равновесное давление паров воды над раствором:
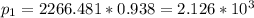 Па
Па
3.
Выражение для степени набухания полимера: (в долях)
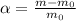
Масса нулевая - масса полимера без воды, масса без индекса - набухший полимер.
Δm = 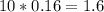 г.
г.
дано
m(ppa K2S) = 50 g
W(K2S) = 22%
V практ( H2S) = 2 L
φ(H2S)-?
m(K2S) = 50*22% / 100% = 11 g
K2S+2HCL-->2KCL+H2S
M(K2S) = 110 g/mol
M(H2S) = 34 g/mol
m(H2S) = m(K2S) * M(H2S) / M(K2S) = 11*34 / 110 = 3.4 g
V теор(H2S) = Vm * m(H2S) / M(H2S) = 22.4 * 3.4 / 34 = 2.24 L
φ(H2S) = V практ(H2S) / V теор(H2S) * 100% = 2 / 2.24 * 100% = 89.3%
ответ 89.3 %